Voici l’enregistrement incroyable
du rythme d’un patient de 62 ans qui a fait un malaise (faiblesse sueurs) après 1 h de sport et chez qui les premiers ECG avaient révélé un aspect d’occlusion coronaire aiguë sans sus-décalage de ST diffus avec ST+ en VR.
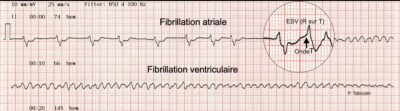
Sur le monitoring cardiaque (tracé long) enregistré en dérivation DII, le rythme passe d’une fibrillation atriale (FA) à une fibrillation ventriculaire (FV) à l’occasion d’une extrasystole ventriculaire (ESV) qui tombe sur le sommet de l’onde T du complexe QRS-T précédent.
Pourquoi ?
• Nous sommes dans un contexte d’infarctus (arrêt du sang dans une artère coronaire, ce qui provoque une souffrance aiguë du myocarde).
• Cette souffrance par ischémie coronaire (ischémie = arrêt du sang) engendre une instabilité du potentiel électrique de repos de nombreuses cellules myocardiques (myocytes).
• Alors que les myocytes bien irrigués par du sang artériel riche en oxygène sont stables électriquement au repos (à -90 mV environ pour répondre plus rapidement à une excitation qui lui donnerait l’ordre de se contracter), un myocyte mal irrigué peut perdre sa capacité à rester électronégatif de façon stable et se « dépolariser » spontanément, devenant alors électropositif brutalement (Cf. Potentiel d’action). On dit qu’il acquiert un « automatisme anormal ».
• La variation brutale du potentiel de membrane de ce myocyte devenu anormalement automatique engendre un minicourant électrique (un influx) prématuré qui peut se propager de proche en proche et dépolariser tout ou partie du myocarde excitable.
• Or, en cas d’infarctus, de nombreux myocytes voisins de ce foyer d’automatisme anormal ont eux-mêmes une activité électrique perturbée en raison du manque d’oxygène et d’énergie (ATP) avec des périodes hyper-vulnérables (près du sommet de l’onde T) et des périodes réfractaires aux excitations, inhomogènes les unes par rapport aux autres. Elles peuvent donc réagir différemment selon la période où les sollicite un influx prématuré de voisinage.
• Un influx prématuré peut donc n’engendrer aucune excitation de voisinage, se propager à l’ensemble du myocarde et engendrer sur l’électrocardiogramme un complexe QRS-T prématuré anormal (appelé extrasystole ventriculaire) ou bien créer des mini foyers électriques qui peuvent s’organiser en tachycardie ventriculaire (mono ou polymorphe) ou pire, désorganiser toute l’activité ventriculaire et engendrer une fibrillation ventriculaire à l’origine d’une mort subite en l’absence de cardioversion par choc électrique (défibrillation).
• Le risque d’arythmie ventriculaire grave augmente avec le nombre, le polymorphisme et surtout « la prématurité » des extrasystoles ventriculaires, plus dangereuses quand elles ont un « couplage court » au complexe QRS précédent et qu’elles tombent au sommet de l’onde T (qui correspond à la période vulnérable de nombreux myocytes).
• Chez notre patiente, on observe sur ce tracé long (60 sec), la survenue d’une seule ESV qui « tombe » au sommet de l’onde T du complexe QRS précédent et cela déclenche la fibrillation ventriculaire… Une ESV qui « tombe au sommet de l’onde T est dite « maligne » et on comprend pourquoi sur le tracé (cf. ESV maligne).
• L’autre originalité de ce tracé est la durée de la fibrillation ventriculaire qui se poursuit jusqu’à épuisement du papier ECG (et peut être du malade) soit au moins 50 secondes, donc plus de 40 secondes après que la patiente ait perdu connaissance et qu’une manœuvre de réanimation soit entreprise… Mais la suite est favorable…
